Un innovativo studio della Champalimaud Foundation rivela il ruolo inatteso del sistema immunitario nel mantenimento dei livelli di zucchero nel sangue durante il digiuno e l’esercizio fisico. Questa scoperta apre nuove prospettive per trattare patologie come il diabete, l’obesità e il cancro
Un ruolo sorprendente per il sistema immunitario
Indice dei contenuti
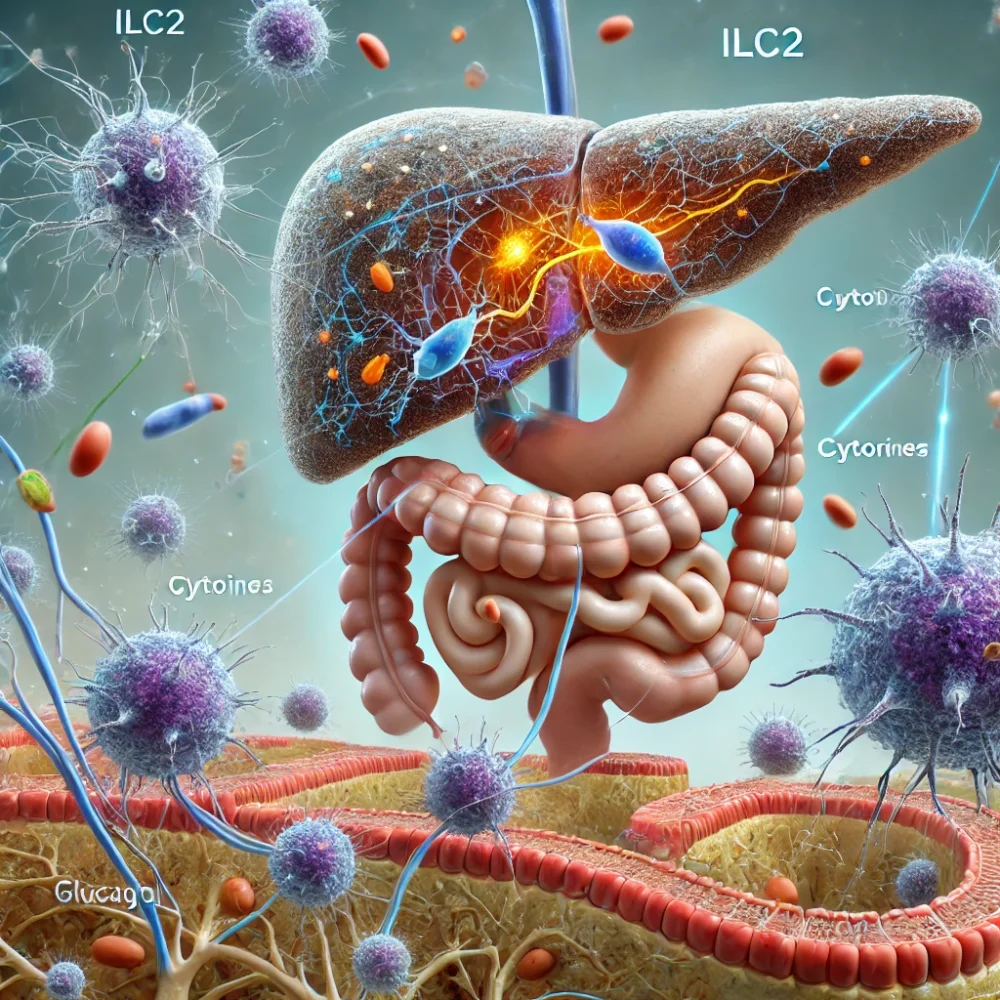
Per decenni, il sistema immunitario è stato studiato principalmente in relazione alla difesa contro le infezioni. Tuttavia, una nuova ricerca pubblicata su Science dimostra che le cellule immunitarie giocano un ruolo essenziale nel mantenere l’omeostasi energetica, agendo come mediatori tra il sistema nervoso, ormonale e gli organi metabolici.
Il team guidato da Henrique Veiga-Fernandes, capo del Laboratorio di Immunofisiologia della Champalimaud Foundation, ha dimostrato che, durante i periodi di bassa energia – come il digiuno o l’attività fisica prolungata – specifiche cellule immunitarie migrano verso il pancreas per regolare i livelli di glucosio nel sangue. Questo processo coinvolge una collaborazione intricata tra sistema nervoso, immunitario e ormonale, precedentemente sconosciuta.
La regolazione classica del glucosio: un panorama ampliato
Tradizionalmente, il controllo dei livelli di zucchero nel sangue è stato attribuito agli ormoni insulina e glucagone, entrambi prodotti dal pancreas. L’insulina riduce il glucosio nel sangue favorendone l’assorbimento nelle cellule, mentre il glucagone stimola il fegato a rilasciare glucosio immagazzinato per sostenere l’energia nei periodi di digiuno o attività.
Ma questa spiegazione, sebbene valida, non era sufficiente per il team di Veiga-Fernandes. «Sapevamo che il sistema immunitario gioca un ruolo nel metabolismo dei grassi. Ci siamo chiesti: potrebbe influenzare anche il metabolismo del glucosio?» spiega il ricercatore. La risposta è arrivata attraverso esperimenti innovativi sui topi.
La scoperta di un circuito immuno-nervoso
Per testare l’ipotesi, i ricercatori hanno studiato topi geneticamente modificati privi di cellule immunitarie innate di tipo 2 (ILC2), un tipo specifico di globuli bianchi. I risultati sono stati sorprendenti.
Senza queste cellule, i livelli di glucosio nel sangue dei topi scendevano drasticamente, dimostrando che le ILC2 erano cruciali per la produzione di glucagone.
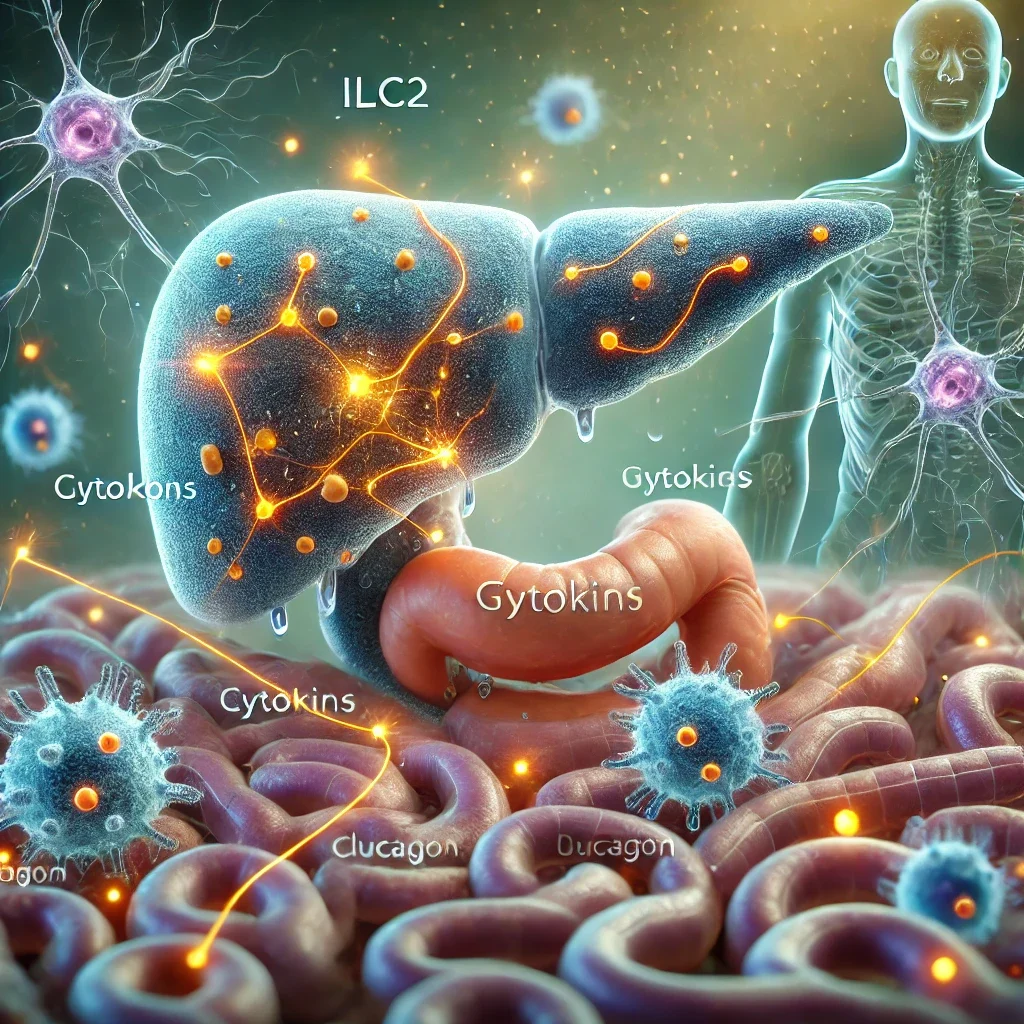
Quando le cellule ILC2 sono state trapiantate nei topi, i livelli di zucchero nel sangue sono tornati alla normalità, confermando il loro ruolo nella regolazione del glucosio. I ricercatori hanno inoltre scoperto che, durante il digiuno, le cellule immunitarie migrano dall’intestino al pancreas, dove rilasciano citochine, molecole messaggere che stimolano le cellule pancreatiche a produrre glucagone.
Un meccanismo orchestrato dal sistema nervoso
Sorprendentemente, la migrazione delle cellule ILC2 è orchestrata dal sistema nervoso. Durante il digiuno, i neuroni intestinali rilasciano segnali chimici che guidano le cellule immunitarie verso il pancreas, cambiando la loro attività genetica per adattarsi alle necessità energetiche del corpo.
«Non avremmo mai immaginato che il sistema nervoso e quello immunitario collaborassero in modo così sofisticato per regolare il metabolismo del glucosio», osserva Veiga-Fernandes. Questo dialogo tra sistemi rappresenta un’importante scoperta nel campo della biologia sistemica.
Implicazioni per la salute umana
I risultati dello studio offrono una comprensione più approfondita di come il corpo umano regoli l’equilibrio energetico in condizioni di stress metabolico, come il digiuno prolungato o l’attività fisica intensa. Queste nuove conoscenze arricchiscono il panorama scientifico e potrebbero avere ricadute pratiche significative nel trattamento di diverse patologie.
Nel diabete, comprendere i meccanismi che regolano i livelli di glucosio potrebbe portare allo sviluppo di terapie più efficaci sia per il diabete di tipo 1, caratterizzato dalla distruzione delle cellule beta pancreatiche, sia per il diabete di tipo 2, dove la resistenza all’insulina rappresenta il problema principale. Tali scoperte potrebbero contribuire non solo a un migliore controllo della glicemia, ma anche alla prevenzione delle complicanze legate alla malattia.
In ambito oncologico, alcune neoplasie, come i tumori neuroendocrini pancreatici, traggono vantaggio dai processi metabolici alterati per alimentare la loro crescita. Analizzare il ruolo del circuito immuno-nervoso nella regolazione del metabolismo tumorale potrebbe offrire strategie terapeutiche innovative, mirate a contrastare l’espansione del tumore interferendo con i suoi meccanismi di sostentamento energetico.
Per quanto riguarda condizioni come l’obesità e la cachessia, entrambe strettamente legate al metabolismo energetico, i benefici di queste scoperte potrebbero essere notevoli. Nell’obesità, caratterizzata da un accumulo eccessivo di grasso corporeo, così come nella cachessia, sindrome debilitante spesso associata a malattie oncologiche e caratterizzata dalla perdita di massa muscolare, il controllo della glicemia e la gestione delle riserve energetiche sono elementi centrali. Nuove modalità di intervento su questi aspetti potrebbero migliorare significativamente la qualità della vita dei pazienti, riducendo l’impatto di tali condizioni.
Digiuno ed evoluzione: una prospettiva storica
Questa scoperta non solo rivoluziona la comprensione del metabolismo, ma offre anche una prospettiva evolutiva. I nostri antenati, spesso esposti a periodi di digiuno forzato, dovevano sviluppare meccanismi di sopravvivenza per mantenere l’energia necessaria al cervello e ai muscoli. Le ILC2 rappresentano uno di questi adattamenti evolutivi, agendo come una “rete di sicurezza” nei momenti di carenza alimentare.
Prospettive future: dalla ricerca alle terapie
Lo studio della Champalimaud Foundation segna solo l’inizio di una nuova era nella ricerca sul metabolismo. Capire come questi meccanismi funzionano – o falliscono – in individui con diabete, obesità, infiammazioni croniche o stress prolungato potrebbe rivoluzionare il trattamento di molte condizioni.
«Stiamo solo grattando la superficie», conclude Veiga-Fernandes. «Vogliamo esplorare come queste interazioni neuro-immuni possano essere sfruttate per migliorare la salute umana. L’obiettivo finale è sviluppare terapie che sfruttino queste scoperte per combattere disturbi metabolici e ormonali».
Fonti
Marko Šestan et al., Le interazioni neuronale-ILC2 regolano il glucagone pancreatico e l’omeostasi del glucosio, Science (2025). DOI: 10.1126/science.adi3624
Champalimaud Foundation, Centro per l’Ignoto